海参肽动物实验结果
一、 增强免疫力试验
实验动物:BALB/c成年小鼠,体重18-22g。
实验分组及受试样品给予时间:实验室自制样品分别设三个剂量组(低剂量组、中剂量组、高剂量组),另外设一个正常对照组,实验小鼠除每天给予基础饲料和水外,每天灌胃受试样品一次(正常对照组灌胃生理盐水),受试样品给予时间为28天。
增强免疫力活性试验分组设计
样品 | 组别 | 灌胃浓度 |
正常对照组 | 生理盐水 | 生理盐水 |
海参肽 | 低剂量组 | 85mg/kg |
中剂量组 | 170mg/kg | |
高剂量组 | 340mg/kg | |
海参多糖 | 低剂量组 | 50mg/kg |
中剂量组 | 100mg/kg | |
高剂量组 | 200mg/kg |
1、脏器指数
小鼠在末次给药后,禁食不禁水12h,称体重,处死后取脾脏及肝脏器官并称重,分别计算脏器指数。
样品 | 体重(g) | 脾脏指数(mg/g) | 肝脏指数(mg/g) |
正常对照组 | 22.45±1.96 | 3.88±0.52 | 35.01±2.04 |
海参肽低剂量组 | 22.33±1.71 | 4.48±0.11 | 44.43±3.77 |
海参肽中剂量组 | 21.72±0.65 | 3.95±0.52 | 40.74±1.28 |
海参肽高剂量组 | 22.15±0.90 | 4.22±1.15 | 49.04±3.70 |
海参多糖低剂量组 | 21.36±1.12 | 3.94±0.59 | 42.79±0.34 |
海参多糖中剂量组 | 22.94±1.38 | 4.96±1.07 | 42.79±1.83 |
海参多糖高剂量组 | 21.27±1.23 | 4.39±0.73 | 45.71±4.54 |
备注:*表示显著性差异(P<0.05)
**表示极显著性差异(P<0.01)
结果显示:各组之间在体重及脏器指数方面无显著性差异。
2、细胞免疫(MTT)
Con A 诱导小鼠脾淋巴细胞转化实验
仪器和材料:RPMI1640细胞培养基、小牛血清、2-巯基乙醇(2-ME)、青霉素、链霉素、刀豆蛋白A(ConA)、盐酸、异丙醇、MTT、Hank’s液、PBS缓冲液(PH7.2-7.4)
纱布或200目筛网、24孔培养板、96孔培养板(平底),手术器械、二氧化碳培养箱、酶标仪、721分光光度计、超净工作台、高压灭菌锅、无菌滤器。
操作规程:无菌取脾,置于盛有适量无菌Hank’s 液的小平皿中,制成细胞悬液, 经200目筛网过滤。用 Hank’s液洗2次,每次离心10 min(1000r/min)。将细胞悬浮于1 mL完全培养液中,计数活细胞数,用 RPMI1640培养液调整其细胞浓度至3×106个/mL。再将细胞悬液分两孔加入 24 孔培养板中,每孔 1 mL,在其中一孔加入75 µL ConA液(相当于7.5µg/mL),另一孔不加作为对照,培养板置于5% CO2、37℃培养 72 h。培养结束前4h,每孔轻轻吸去上清液0.7mL,加入不含小牛血清的RPMI 1640培养液,同时加入MTT(5mg/mL)50µL/孔,继续培养4 h。培养结束后,每孔加入1mL酸性异丙醇,吹打均匀,使紫色结晶完全溶解。然后分装到96孔培养板中,每个孔作3个平行孔,使用酶标仪以570 nm 波长测定光密度值。淋巴细胞的增殖能力=ODCon A-OD 无
样品 | 淋巴细胞增殖能力 |
正常对照组 | 0.0122±0.0087 |
海参肽低剂量组 | 0.0126±0.0121 |
海参肽中剂量组 | 0.0177±0.0140 |
海参肽高剂量组 | 0.051±0.0367** |
海参多糖低剂量组 | 0.0167±0.0031 |
海参多糖中剂量组 | 0.0228±0.0237 |
海参多糖高剂量组 | 0.0326±0.0195* |
备注:*表示显著性差异(P<0.05)
**表示极显著性差异(P<0.01)
从试验结果中可以看出,与对照组相比,海参肽的高剂量组以及海参多糖的高剂量组在淋巴细胞增殖能力方面具有显著性差异,因此可以判定,此项结果中海参肽和海参多糖在细胞免疫方面均有较好的增强免疫力效果。
3、血清溶血性测定
用SRBC免疫动物后,产生抗SRBC抗体(溶血素),利用其凝集SRBC的程度来检测溶血素的水平。
每只鼠腹腔注射0.2mL 2%的SRBC进行免疫,4-5天后,摘除眼球取血于离心管内,放置约1h,将凝固血与管壁剥离,使血清充分析出,2000r/min离心10min,收集血清。用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝实验板内,每孔100µL,再加入100µL 0.5%的SRBC悬液,混匀,装入湿润的平盘内加盖,于37℃温箱孵育3h,观察血球凝集程度。计算抗体积数,受试样品组的抗体积数显著高于对照组的抗体水平,可判定该项实验结果阳性。
样品 | 抗体积数 |
正常对照组 | 74.67±4.38 |
海参肽低剂量组 | 76.00±4.61 |
海参肽中剂量组 | 76.67±4.13 |
海参肽高剂量组 | 87.10±4.38* |
海参多糖低剂量组 | 79.67±4.61 |
海参多糖中剂量组 | 87.67±4.38* |
海参多糖高剂量组 | 96.00±4.61* |
备注:*表示显著性差异(P<0.05)
**表示极显著性差异(P<0.01)
从结果来看,海参肽的高剂量组、海参多糖的中、高剂量组与对照组相比,抗体积数水平显著增大,因此此项结果可以判定海参肽及海参多糖在体液免疫方面有一定的作用。
结论:在增强免疫力方面,海参肽及海参多糖的高剂量组对增强免疫力也有一定效果。
二、缓解体力疲劳
实验动物:BALB/c成年小鼠,体重18-22g。
实验分组及受试样品给予时间:实验室自制样品分别设三个剂量组(低剂量组、中剂量组、高剂量组),另外设一个正常对照组,实验小鼠除每天给予基础饲料和水外,每天灌胃受试样品一次(正常对照组灌胃生理盐水),受试样品给予时间为28天。
缓解体力疲劳活性实验分组设计
样品 | 组别 | 灌胃浓度 |
正常对照组 | 生理盐水 | 生理盐水 |
海参肽 | 低剂量组 | 85mg/kg |
中剂量组 | 170mg/kg | |
高剂量组 | 340mg/kg |
1、 负重游泳实验
仪器与器材:游泳桶、电子天平、铅皮
实验步骤:参照《保健食品检验与评价技术规范》2003版进行。具体为:末次给予受试样品30min后,将尾根部负荷5%体重铅皮的小鼠置于游泳桶内游泳。水深不少于30cm,水温25℃±1.0℃,记录小鼠自游泳开始至死亡的时间,即小鼠负重游泳时间。
样品 | 游泳时间(S) |
正常对照组 | 852±315 |
海参肽低剂量组 | 1330±746* |
海参肽中剂量组 | 1455±850* |
海参肽高剂量组 | 1020±570 |
备注:*表示显著性差异(P<0.05)
**表示极显著性差异(P<0.01)
从上述结果可以看出,海参肽的三个剂量组与正常对照组相比,小鼠游泳时间均延长,且低、中剂量组与对照组相比,存在显著性差异。
2、 血清尿素氮测定
材料与试剂:小鼠血清,血尿素氮测定试剂盒(南京建成生物工程研究所),其他试剂均为分析纯。
实验步骤:末次给予受试样品30min后,在温度为30℃的水中不负重游泳90min,休息60min后采血。小鼠拔眼球采全血约0.5ml(不加抗凝剂)。 置 4℃冰箱约3h,血凝固后2000r/min离心15min,取血清备用。血清中的尿素在室温下可稳定24h,在4~6℃可稳定7d以上。参照《保健食品检验与评价技术规范》(2003版)用二乙酰-肟法测定。测定步骤按试剂盒操作。
样品 | 尿素氮含量(mmol/L) |
正常对照组 | 10.72±1.75 |
海参肽低剂量组 | 10.24±3.01 |
海参肽中剂量组 | 7.59±1.32* |
海参肽高剂量组 | 10.09±3.41 |
备注:*表示显著性差异(P<0.05)
**表示极显著性差异(P<0.01)
从试验结果来看,海参肽中剂量组与对照组相比存在显著性差异,其他组与对照组相比没有显著性差异,但低剂量组与高剂量组在尿素氮含量上均比正常对照组含量少,虽然没有显著性差异,但是有一定的效果。
3、肝糖原测定
仪器:分光光度计、离心机、手持式匀浆机、电子天平、移液器
材料与试剂:小鼠肝脏,肝糖原测定试剂盒(南京建成生物工程研究所),其他试剂均为分析纯。
实验步骤:末次给样后30min处死动物,取新鲜肝脏样品,用生理盐水漂洗后用滤纸吸干,称重。用手持式匀浆机充分匀浆后,离心取上清,按试剂盒操作进行测定。
样品 | 肝糖含量(mg/g) |
正常对照组 | 1.61±0.18 |
海参肽低剂量组 | 2.93±1.12** |
海参肽中剂量组 | 2.83±0.81** |
海参肽高剂量组 | 2.86±0.47** |
备注:*表示显著性差异(P<0.05)
**表示极显著性差异(P<0.01)
从试验结果来看,各组与对照组之间相比均存在极显著性差异,说明该项实验结果为阳性。
结论:在缓解体力疲劳方面,海参肽具有明显的效果。
三、解酒护肝
实验动物:BALB/c成年小鼠,单一性别,雄性,体重18-22g。
实验分组及受试样品给予时间:实验室自制样品分别设三个剂量组(低剂量组、中剂量组、高剂量组),另外设一个空白对照组,模型组及阳性对照组。
解酒护肝实验分组设计
样品 | 组别 | 灌胃浓度 |
空白对照组 | 生理盐水 | |
模型组 | 生理盐水+酒 | |
阳性对照组 | 海王金樽+酒 | 0.15ml/10g |
海参肽 | 低剂量组+酒 | 85mg/kg |
中剂量组+酒 | 170mg/kg | |
高剂量组+酒 | 340mg/kg | |
海参皂苷 | 低剂量组+酒 | 20mg/kg |
中剂量组+酒 | 40mg/kg | |
高剂量组+酒 | 80mg/kg |
操作规程:每日空白组与模型组给予等体积的生理盐水,阳性对照组给予海王金樽0.15ml/10g,各给药组每日灌胃相应剂量药物进行保护,30min后除空白组外,其余各组以 0.1 mL/10g 灌胃56 度红星二锅头或50%乙醇(用双蒸水稀释无水乙醇),持续14 d。禁食12小时后处死动物,进行各项指标的检测及病理组织学检查。每周称量体重两次。
1、 体重及脏器指数
样品 | 体重(g) | 肝脏指数(mg/g) |
空白对照组 | 22.96±1.44 | 42.8±2.5 |
模型组 | 19.45±1.33 | 43.1±5.2 |
阳性对照组 | 20.10±1.97 | 41.3±8.9 |
海参肽低剂量组 | 19.55±2.16 | 45.5±2.2 |
海参肽中剂量组 | 18.62±1.01 | 41.4±6.8 |
海参肽高剂量组 | 19.04±1.23 | 40.1±4.3 |
海参皂苷低剂量组 | 18.49±2.4 | 40.7±5.1 |
海参皂苷中剂量组 | 19.22±1.34 | 44.1±4.5 |
海参皂苷高剂量组 | 18.93±0.72 | 42.6±6.2 |
备注:*表示显著性差异(P<0.05)
**表示极显著性差异(P<0.01)
从试验结果可以看出,阳性对照组以及所有样品组与模型对照组相比,体重及脏器指数均无显著性差异。但与空白对照组相比,模型组、阳性对照组及各受试样品组的体重均显著性降低,小鼠消瘦,但脏器指数与空白对照组相比无显著性差异。
2、过氧化脂质降解产物丙二醛(MDA)、还原型谷胱甘肽(GSH)、甘油三酯(TG)含量的测定。
样品 | 甘油三酯含量(mmol/gprot) | 丙二醛含量(mmol/mgpro) | 谷胱甘肽含量(μmol/gprot) |
空白对照组 | 0.310±0.0722 | 2.857±1.063 | 9.05±3.06 |
模型组 | 0.377±0.1566 | 2.940±0.637 | 6.41±1.48 |
阳性对照组 | 0.286±0.0501 | 2.358±0.919 | 11.48±3.08* |
海参肽低剂量组 | 0.213±0.0908* | 2.340±0.514 | 10.78±2.82* |
海参肽中剂量组 | 0.250±0.0776 | 2.689±0.420 | 9.96±1.92* |
海参肽高剂量组 | 0.232±0.0301* | 2.413±0.178 | 14.74±3.77* |
海参皂苷低剂量组 | 0.306±0.1535 | 2.028±0.550 | 10.07±2.49 |
海参皂苷中剂量组 | 0.318±0.0621 | 2.784±0.703 | 10.23±2.77* |
海参皂苷高剂量组 | 0.341±0.1033 | 1.645±0.719* | 9.91±2.80 |
备注:*表示显著性差异(P<0.05)
**表示极显著性差异(P<0.01)
从试验结果分析:与模型组相比,海参肽的低、高剂量组能显著性降低血清中甘油三酯(TG)的水平,阳性对照组以及其他受试样品组也都能在一定程度上降低甘油三酯含量,但没有显著性差异(P>0.05)。与模型组对比,阳性对照组与各受试剂量组也都能降低丙二醛(MDA)的含量,且海参皂苷高剂量组存在显著性差异;其余各组不存在显著性差异。与模型组对比,阳性对照组、海参肽的三个剂量组以及皂苷的中剂量组均能显著性提高还原型谷胱甘肽(GSH)的含量,且差异显著(P<0.05),皂苷的低、高剂量组也能提高还原型谷胱甘肽的含量,只是没有显著性差异。因此,从上述试验结果可知,海参肽在降低小鼠血清甘油三酯含量,提高还原型谷胱甘肽方面有一定的作用。
3、 肝组织病理学检测
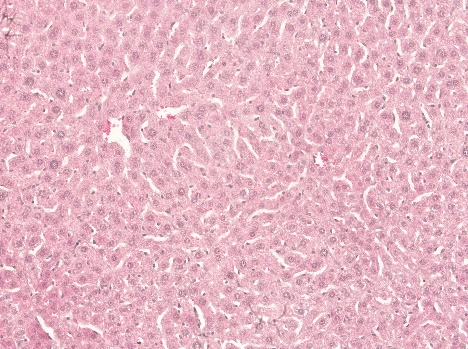

空白对照组 模型对照组


阳性对照组 海参肽高剂量组

海参皂苷高剂量组
空白对照组:肝索排列整齐,肝内无脂肪病变。
模型组:肝脏部分出现水肿,局部出现急性坏死,伴随轻微的脂肪病变。
阳性对照组:出现部分水肿,部分坏死。
海参肽高剂量组:出现部分急性坏死,无脂肪变性,恢复较好。
海参皂苷高剂量组:出现部分水肿,肝索轻微紊乱。
结论:从生化指标及组织病理学结果来看,海参肽具有一定的解酒护肝的功效。 海参皂苷在提高还原型谷胱甘肽及降低丙二醛含量方面也有一定的效果。
上一篇:“破圈”的糖酒会
 售前咨询专员
售前咨询专员
